-
Recently Browsing 0 members
- No registered users viewing this page.
-
Topics
-
Posts
-
Leuk dat dit alles nog steeds bewaard is gebleven. Zit met genoegen weer heel veel nieuws te lezen.
-
By PureChemical · Posted
Dag allen, Voor wie het leuk vindt is er een redelijk actieve (europeese) Pyro discord chat te vinden op https://discord.gg/KFJQXwcbnV Greets, Pchem -
By Vbvuurwerk · Posted
Goede morgen, Hier een liefhebber uit Noord-Holland van deze fantastische hobby waarbij m'n interesse altijd ligt om hoe iets werkt. ben vooral een lezer en geen poster dus zal hier voornamelijk zijn om informatie te winnen. en hopelijk in de toekomst toch iets te kunnen maken al zal het de kleine experimentjes wezen die in de scheikunde lessen gedaan worden. -
By afterburner · Posted
Hoi allemaal, Afterburner hier. Een pyro met een organische chemische achtergrond, gestationeerd in het zuiden van Nederland. Mijn pyro passie uit zich tegenwoordig voornamelijk in de vorm van pyro reizen, maar alle aspecten spreken me nog altijd aan! Ik ben benieuwd wat het forum allemaal te bieden heeft, ben hier een lange tijd niet actief geweest! We spreken elkaar!
-
Who's Online (See full list)
- There are no registered users currently online
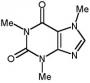

Recommended Posts